بررسی BCR-ABL1 fusion gene و سرطان خون:
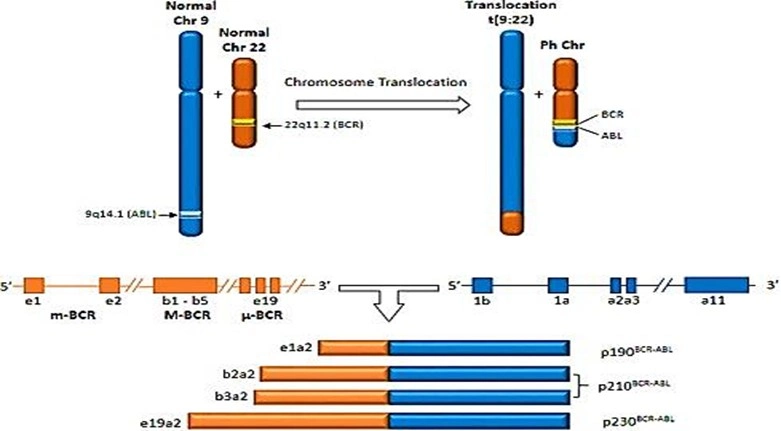
در این آزمایش حضور ژن فیوژن BCR-ABL بر روی کروموزوم 22 (جابجایی بین کروموزوم های 9 و 22) مورد بررسی قرار می گیرد. در طی این جابجایی ژن ABL1 از کروموزوم 9 به ناحیه ژنی BCR کروموزوم 22 متصل می شود. کروموزوم 22 حاصل که توالی ژن BCR-ABL را دارد به عنوان کروموزوم فیلادلفیا(Ph – Philadelphia) شناخته میشود؛ به این علت که اولین بار در آنجا کشف شد.
سرطان خون (Leukemia – لوسمی) یک بیماری پیشرونده و بدخیم اعضاء خون ساز بدن است که بر اثر تکثیر و تکامل ناقص گلبول های سفید خون (WBC) و پیش سازهای آن در خون و مغز استخوان ایجاد می شود. لوسمی مزمن میلوئیدی (CML) یکی از انواع سرطان خون است که روندی مزمن دارد و در آن میلوسیت ها (Myelocytes) که عامل ساخت بافتهای مغز استخوان هستند، تحت تاثیر قرار میگیرند. لوسمی حاد لنفوئیدی (ALL) از انواع دیگر سرطان خون است که روندی حاد داشته و طی آن لنفوسیت ها (Lymphocytes) که در ساخت بافتهای لنفاوی نقش دارند، تحت تاثیر قرار می گیرند.
کروموزوم فیلادلفیا که حاوی یک ژن فیوژن غیرطبیعی BCR-ABL است، یک پروتئین غیر طبیعی را تولید میکند و منجر به ایجاد بیماری CML و یک نوع ALL می شود. این کروموزوم در حدود 95% از بیماران مبتلا به CML و %30 از بیماران بزرگسال مبتلا به ALL و 4% از کودکان مبتلا به ALL مشاهده می شود.
انواع BCR-ABL1 و تفاوت آن ها:
تا کنون سه ناحیه شکستگی عمده درون ژن BCR شناسایی شده است که شامل M-BCR (major-BCR)، m-BCR (minor-BCR) و µ-BCR (micro-BCR) می باشد. M-BCR شامل دو نوع شکستگی است: یکی پس از اگزون 13 (e13) که منجر به ایجاد الحاق e13/a2 (b2a2) و دیگری پس از اگزون 14 (e14) که منجر به ایجاد الحاق e14/a2 (b3a2)می شود. mRNA های رونویسی شده از هر دوی ژن های الحاقی ذکر شده، به یک پروتئین 210 کیلودالتونی(P210) ترجمه می شوند. در m-BCR شکستگی پس از اگزون 1(e1) رخ می دهد و منجر به ایجاد ژن الحاقی e1a2 می شود و در ادامه mRNA الحاقی حاصل به یک پروتئین 190 کیلودالتونی (P190) ترجمه می شود. µ-BCR در نتیجه شکستگی در اگزون 19 (e19) ایجاد شده و به تشکیل ژن الحاقی e19a2 منتهی می گردد که این mRNA الحاقی به یک پروتئین 230 کیلودالتونی (P230) ترجمه می شود.
این آزمایش به دو روش مولکولی کیفی و کمّی انجام می شود. روش کیفی جهت تشخیص اولیه و روش کمّی جهت بررسی تغییرات میزان BCR-ABL در بدن بیمار می باشد.
نتیجه مثبت در روش کیفی، نشان دهنده تشخیص CML و یا نوعی از ALL (Ph+) است.
نتیجه منفی گزارش می کند که نوع جهش یافته موتاسیون مربوطه در نمونه شخص یافت نشده است